మూలకము
Contributors to Wikimedia projects
 Article Images
Article Images
మూలకము
(మూలకాలు నుండి దారిమార్పు చెందింది)
రసాయన శాస్త్రంలో మూలకం అనేది పదార్థానికి సంబంధించిన మౌలికమైన భావం. ఒక పదార్థం యొక్క అణు (atom) గర్భంలో ఉన్న ప్రోటానులనే పరమాణువులు ఎన్ని ఉన్నాయో ఆ సంఖ్యని అణు సంఖ్య (atomic number, Z) అంటారు. ఆ అణు సంఖ్యని బట్టి ఆ పదార్థం ఏ మూలకమో తెలుస్తుంది. ఉదాహరణకి ఆమ్లజని అణు సంఖ్య 8 కనుక అణు గర్భంలో 8 ప్రోటానులు ఉన్న అణువులు అన్నీ ఆమ్లజని అణువులు అయి తీరాలి. భూగ్రహం మీద ద్రవ్యరాశిలో అత్యధిక పుష్కలత ఉన్న మూలకం ఇనుము (Fe); భూమి ద్రవ్యరాశిలో 89% ఇనుమే! కాని మనకి అందుబాటులో ఉన్న పెచ్చు (crust)లో అత్యధిక ద్రవ్యరాశిలో ఉన్న మూలకం ఆమ్లజని; ఇది 46.5% ఉంది. [1]
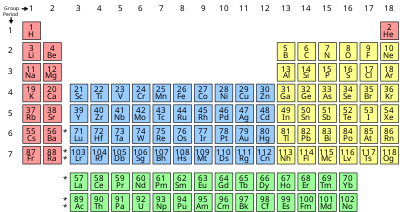
ఇప్పటివరకు తెలిసిన 118 మూలకాలలో, 94 మూలకాలు ప్రకృతిలో లభించేవి, మిగిలిన 24 కృత్రిమంగా తయారుచేసినవి. వీటిల్లో 80 మూలకాలకి స్థిరనిశ్చలత గల ఏకస్థానులు (isotopes) ఉన్నాయి. మిగిలినవి వికీర్ణ ఏకస్థానులు (radio-isotopes); ఇవి కాలక్రమాన క్షీణించి స్థిరనిశ్చలత గల మూలకాలలోకి మారిపోతాయి.
భూగ్రహం మీద ద్రవ్యరాశిలో అత్యధిక పుష్కలత ఉన్న మూలకం ఇనుము (Fe); భూమి ద్రవ్యరాశిలో 89% ఇనుమే! కాని మనకి అందుబాటులో ఉన్న పెచ్చు (crust)లో అత్యధిక ద్రవ్యరాశిలో ఉన్న మూలకం ఆమ్లజని; ఇది 46.5% ఉంది. [1]
- సారణి 1: భూగ్రహపు పెచ్చు మీద దొరికే (ద్రవ్యరాశిలో) అత్యధిక పుష్కలత ఉన్న మూలకాలు
| మూలకం పేరు (ఇంగ్లీషులో) | మూలకం పేరు (తెలుగులో) | హ్రస్వ నామం | పుష్కలత (మిలియను భాగాలలో వాటా, ppm) |
|---|---|---|---|
| Oxygen | ఆమ్లజని | O | 465,000 లేదా 46.5% |
| Silicon | సైకము | Si | 282,000 లేదా 28.2% |
| Aluminum | అల్లూమినం | Al | 82,300 లేదా 8.23% |
| Iron | ఇనుము | Fe | 56,300 లేదా 5.63% |
| Calcium | ఖటికం | Ca | 41,500 లేదా 4.15% |
| Sodium | సోడియం | Na | 23,600 లేదా 2.36% |
| Magnesium | మంగనం | Mg | 23,300 లేదా 2.33% |
| Potassium | పొటాసియం | K | 20,900 లేదా 2.09% |
| Titanium | టైటేనియం | Ti | 5,560 లేదా 0.556% |
| Hydrogen | ఉదజని | H | 1,450 లేదా 0.0145% |
- సారణి 2: భూగ్రహపు పెచ్చు మీద దొరికే ఇతర మూలకాల పుష్కలత
| మూలకం పేరు (ఇంగ్లీషులో) | మూలకం పేరు (తెలుగులో) | హ్రస్వ నామం | పుష్కలత (మిలియను భాగాలలో వాటా, ppm) |
|---|---|---|---|
| Nitrogen | నత్రజని | N | 19 ppm |
| Hafnium | హేప్నియం | Hf | 3 ppm |
| Uranium | యురేనియం | U | 2.7 ppm |
| Terbium | టెర్బియం | Tb | 1 ppm |
| Silver | వెండి | Ag | 0.075 ppm |
| Platinum | ప్లేటినం | Pt | 0.005 ppm |
| Gold | బంగారం | Au | 0.004 ppm |
| Astanine | ఏస్టనీన్ | As | లేశం |
మూలకాలని ఒక బాణీలో అమర్చిన తీరుని ఆవర్తన పట్టిక అంటారు. పట్టికలోని నిలువు వరుసలను "గ్రూపులు" లేదా గుంపులు లేదా "కుటుంబాలు" అనిన్నీ, అడ్డు వరుసలని శ్రేణులు, "ఆవర్తులు" లేదా "పీరియడ్లు" అనీ అంటారు. ఆవర్తన పట్టికలో 18 గుంపులు, 7 ఆవర్తులు ఉన్నాయి. ఈ పట్టికలో మొట్టమొదటి (ఆవర్తు 1, గుంపు 1) గదిలో ఉదజని (Hydrogen) ఉంటుంది. రెండవ గదిలో రవిజని (Helium) ఉంటుంది. ఒకే గుంపులో ఉన్న మూలకాల లక్షణాలలో గట్టి పోలికలు కనిపిస్తాయి. ఉదాహరణకి లవజనులు (halogens) ఉన్న గుంపులో కనిపించే ఫ్లోరీను (F), క్లోరీను (Cl), బ్రోమీను (Br), అయొడీను (I) లక్షణాలలో ఒక బాణీ కనిపిస్తుంది. ఒక ఆవర్తులో ఎడమ నుండి కుడికి పోయే కొద్దీ ఆ మూలకంలోని ఎలక్ట్రానుల సంఖ్య పెరుగుతూ ఉంటుంది. ఎడమ నుండ కుడకి ఆవర్తుల వారీగా చూస్తే మూలకాల లక్షణాలు ఒక బాణీలో కొంతసేపు పెరిగి, కొంతసేపు తగ్గి, మరల పెరుగురతూ కనిపిస్తాయి. దీనినే మెండలియవ్ ఆవర్తన సూత్రం (Mendeleev’s Periodic Law) అంటారు.
- జడవాయు మూలకాలు (Noble gases): ఆవర్తన పట్టికలో '0' గ్రూపు (లేదా 18 వ నిలువు వరుస)కి చెందిన మూలకాలను జడవాయువు మూలకాలు అంటారు. అవి: హీలియం (He), నియాన్ (Ne), ఆర్గాన్ (Ar), క్రిప్టాన్ (Kr), జినాన్ (Xe), రేడాన్ (Rd).
- క్షార లోహాలు (alkali metals): ఆవర్తన పట్టికలో 1వ నిలువు వరుస (గ్రూపు)లో ఉన్న మూలకాలని (ఉదహజనిని మినహాయించి) క్షార లోహాలు (alkali metals) అంటారు. అవి: లిథియం (Li), సోడియం (Na), పొటాసియం (K), రుబీడియం (Rb), సీజియం (Cs), ఫ్రాన్సియం (Fr).
- ఆవర్తన పట్టికలోని 2వ నిలువు వరుస (గ్రూపు)లో ఉన్న ఆరు మూలకాలని క్షార మృత్తిక లోహాలు (alkali earth metals) అంటారు. వాటి పేర్లు: బెరిలియం (Be), మెగ్నీసియం (Mg), కేల్సియం (Ca), స్ట్రాంటియం (Sr), రేడియం (Ra). వీటి ఉమ్మడి లక్షణం ఏమిటంటే ఇవన్నీ వెండిలా మెరుస్తాయి, గది ఉష్ణోగ్రత దగ్గర చర్యాశీలత కలిగి ఉంటాయి.
- ఆవర్తన పట్టికలోని లేంథనైడ్ శ్రేణిలోని 15 మూలకాలు, స్కేండియం (Sc), ఇట్రియం (Y), వెరసి 17 మూలకాలని విరళ మృత్తిక లోహాలు (rare-earth metals) అంటారు. పేరుకే విరళం కాని ఇవి నిజానికి భూమిలోని గనులలోవిస్తారంగానే దొరుకుతాయి.
- ఆవర్తన పట్టికలోని ఏక్టినైడ్ శ్రేణిలోని మూలకాలని వికిరణాత్మక విరళ మృత్తిక మూలకాలు (radioactive rare-earth elements) అంటారు.
మూలకాల ఎలక్ట్రాన్ విన్యాసాల ఆధారంగా నీల్స్ బోర్ విస్తృత ఆవర్తన పట్టికను నిర్మించాడు. అన్ని మూలకాలను వాటి పరమాణు సంఖ్యల ఆరోహణ క్రమంలో అమర్చడం జరిగింది. ఆవర్తన పట్టికలో ఎడమ నుంచి కుడికి పోయిన కొద్దీ ఒక మూలకం పరమాణు సంఖ్య కంటే దాని తరువాత మూలకం పరమాణు సంఖ్య ఒకటి చొప్పున పెరుగుతుంది. అనగా, ఒక మూలకం ఎలక్ట్రాన్ విన్యాసానికి దాని ముందు మూలకం ఎలక్ట్రాన్ విన్యాసం కంటే ఒక ఎలక్ట్రాన్ అధికంగా ఉంటుంది. ఇలా ఆ పరమాణువులో చివరగా చేరే ఎలక్ట్రాన్ ను 'భేదపరచే ఎలక్ట్రాన్' అంటాం.
- బ్లాకులుగా వర్గీకరణ: ఆవర్తన పట్టికలో మూలకాల ఎలక్ట్రాన్ విన్యాసాల ఆధారంగా 4 బ్లాకులు ఉన్నాయి. ఒక మూలకంలో భేదపరిచే ఎలక్ట్రాన్ 's' ఉపకర్పరంలోకి పోతే ఆ మూలకాన్ని s బ్లాకులో చేర్చడం జరుగుతుంది. ఇదే విధంగా మిగిలిన మూడు p, d, f బ్లాకులు ఆవర్తన పట్టికలో చూపించడం జరిగింది. 's' బ్లాక్ ఎడమవైపు, 'p' బ్లాక్ కుడివైపు, 'd' బ్లాక్ s, p బ్లాక్ లకు మధ్యగానూ ఉన్నాయి. శక్తి స్థాయి క్రమానుసారంగా 'f' బ్లాక్ ను అమర్చినట్లయితే, ఆవర్తన పట్టిక చాలా పొడవుగా ఉంటుంది. కాబట్టి ఈ బ్లాక్ ను ఆవర్తన పట్టిక కింది భాగంలో ప్రత్యేకంగా చూపుతారు. ఎలక్ట్రాన్ విన్యాసాలు ఆధారంగా మూలకాలను అమర్చితే నాలుగు బ్లాక్ లు ఏర్పడటమే కాకుండా బాహ్యకర్పరంలో ఒకే రకం ఎలక్ట్రాన్ విన్యాసం గల మూలకాలు అన్నీ గ్రూపు అని పిలిచే ఒక నిలువు వరుసలో ఉంటాయి. ఒకే గ్రూపు మూలకాలన్నిటి మధ్య గట్టి పోలికలు ఉన్న రసాయన ధర్మాలుంటాయి.
- గ్రూపులుగా వర్గీకరణ: బాహ్య కర్పరంలోని 's' ఆర్బిటాల్ లో ఒక ఎలక్ట్రాన్ గల (ns1) మూలకాలను 'I గ్రూపు మూలకాలు' అంటాం (ఉ.హైడ్రోజన్, ఆల్కలీ లోహాలు). బాహ్య కర్పరంలోని 's' ఆర్బిటాల్ లో రెండు ఎలక్ట్రాన్ లు గల (ns²) మూలకాలను 'II గ్రూపు మూలకాలు' అంటారు (ఉ. క్షార మృత్తిక లోహాలు). బాహ్య కర్పరంలో మూడు ఎలక్ట్రానులు, 's' లో రెండు, 'p' లో ఒకటి (ns² p1) 'III గ్రూపు మూలకాలు' అంటాం. ఇదే విధంగా నాలుగు, ఐదు, ఆరు, ఏడు, ఎనిమిది ఎలక్ట్రానులు వరసగా ఉన్న మూలకాలను IV, V, VI, VII, 0 గ్రూపు మూలకాలు అంటాం.
- ప్రాతినిధ్య మూలకాలు : ఆవర్తన పట్టికలో 's', 'p' బ్లాకు మూలకాలను ప్రాతినిధ్య మూలకాలంటారు. అవి: కొన్ని లోహాలు, అన్ని అలోహాలు, అర్ధలోహాలు.
- పరివర్తన మూలకాలు : ఇవి 'd' బ్లాకు మూలకాలు.
- అంతర్ పరివర్తన మూలకాలు : ఇవి 'f' బ్లాకు మూలకాలు.
ఈ విస్తృత ఆవర్తన పట్టికలో మూలకం పేరు, సంకేతం, పరమాణు సంఖ్య, సగటు పరమాణు ద్రవ్యరాశి విలువలు ఉంటాయి. ఈ ఆవర్తన పట్టిక రసాయన మూలకాలను ఒక క్రమమైన పట్టికలో సూచించు విధానము. దీని ఆవిష్కరణ కు ఆధ్యుడు రష్యా దేశస్తుడైన డిమిట్రీ మెండలీఫ్. ఈయన 1869 వ సంవత్సరంలో మొదటి ఆవర్తన పట్టికకు రూపకల్పన చేశారు. మెండలీఫ్ రసాయన మూలకాలను వాటి ధర్మాల ఆధారంగా పట్టికలో అమర్చాడు. క్రొత్త మూలకాలు కనుగొన్న తదుపరి ఈ పట్టికను విస్తృతపరచడమైనది. ఈ ఆవర్తన పట్టిక విస్తరణ మూలకాల ధర్మములు, వాటి ఎలక్ట్రాన్ విన్యాసం ఆధారంగా తయారుచేయబడినది[2]
- ↑ 1.0 1.1 Los Alamos National Laboratory (2011). "Periodic Table of Elements: Oxygen". Los Alamos, New Mexico: Los Alamos National Security, LLC. Retrieved 7 May 2011.
- ↑ "The periodic table of the elements". International Union of Pure and Applied Chemistry. 2007-07-22. Archived from the original on 2008-02-13. Retrieved 2008-02-08.
- ↑ Meija, Juris; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ 4.0 4.1 Meija, Juris; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3). Table 1: Standard atomic weights 2013, pp. 272–274. doi:10.1515/pac-2015-0305.
- ↑ Meija, Juris; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3). Table 2, 3 combined; uncertainty removed. doi:10.1515/pac-2015-0305.
- IUPAC periodic table (Retrieved 20 June 2005)
- WebElements Periodic table (professional edition) (Retrieved 20 June 2005)
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107–1122, 2003
- IUPAC Standard Atomic Weights Revised Archived 2008-03-05 at the Wayback Machine (2005).
- WebElements.com
- NIST's X-Ray Mass Attenuation Coefficients of Elements
- NIST's Table of Physical Properties of Elements
- Los Alamos version (for American school children, but contains more of the history)